白介素-12(IL-12)
IL-12的分子結(jié)構(gòu)
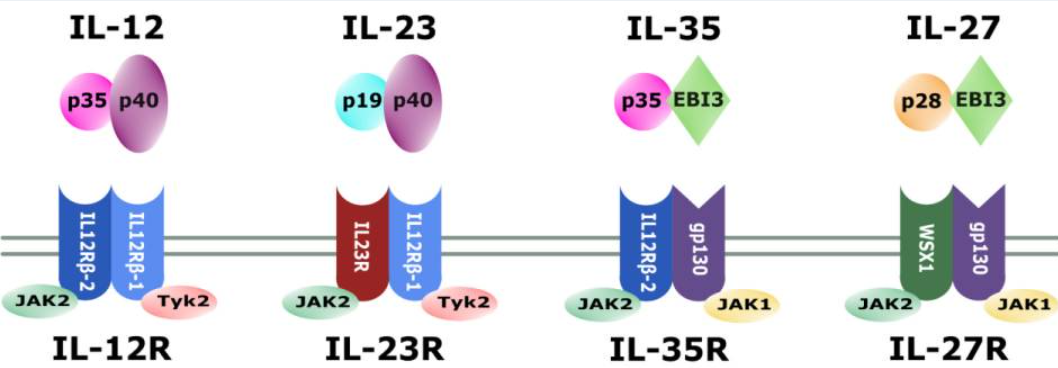
IL-12是一種異源二聚體細(xì)胞因子,由α鏈p35(約35 kDa)和β鏈p40(約40 kDa)組成。這兩個(gè)亞基分別由不同基因編碼(人類基因位于第3號(hào)和5號(hào)染色體)。值得注意的是,p35本身不具備獨(dú)立分泌的能力,必須與p40結(jié)合后才能正確折疊并分泌為生物活性的IL-12異質(zhì)二聚體(通常稱為IL-12p70)。IL-12家族其它成員也采用類似結(jié)構(gòu):例如IL-12p40與另一α鏈IL-23p19可組成IL-23,而p35也可與EBI3(EB病毒誘導(dǎo)基因3)結(jié)合形成免疫抑制性細(xì)胞因子IL-35。這種共享亞基機(jī)制使得IL-12與IL-23等細(xì)胞因子在結(jié)構(gòu)上具有親緣關(guān)系。
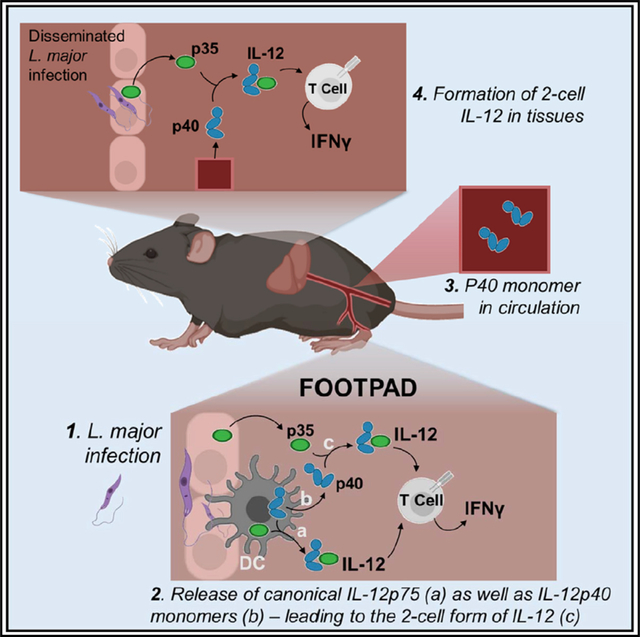
IL-12p40亞基在血清和細(xì)胞培養(yǎng)上清中常以過量單體形式出現(xiàn),并能形成p40-p40同二聚體。研究表明,p40同二聚體可拮抗IL-12p70促進(jìn)IFN-γ產(chǎn)生的活性,盡管其生理意義尚未完全明了。p40單體過量分泌可能參與調(diào)節(jié)免疫平衡,而p35的表達(dá)則更加廣泛,但僅在與p40結(jié)合后才能發(fā)揮作用。
IL-12受體的組成與表達(dá)分布
IL-12的細(xì)胞表面受體由兩個(gè)跨膜亞基構(gòu)成:IL-12Rβ1和IL-12Rβ2。其中IL-12Rβ1與IL-23受體共用(IL-23信號(hào)復(fù)合體由IL-12Rβ1和專屬的IL-23R構(gòu)成),而IL-12Rβ2則特異性地與IL-12結(jié)合形成高親和力受體。IL-12Rβ1與IL-12Rβ2同屬于gp130家族,其胞外結(jié)構(gòu)域與gp130蛋白具有同源性。在免疫細(xì)胞中,兩種亞基主要表達(dá)在活化的T淋巴細(xì)胞和NK細(xì)胞表面。活化狀態(tài)下的B細(xì)胞也可表達(dá)IL-12受體:在IFN-γ和IL-12共同作用下,人B細(xì)胞上調(diào)IL-12Rβ2表達(dá),并在IL-12刺激下發(fā)生STAT4磷酸化,表明B細(xì)胞在特定條件下也能響應(yīng)IL-12信號(hào)。值得一提的是,IL-12Rβ1的親和力較低(Kd ~2–6 nM),每細(xì)胞表達(dá)數(shù)量較多(約1000–5000個(gè)受體),而IL-12Rβ2則為高親和力受體(Kd ~5–20 pM),表達(dá)數(shù)量相對(duì)較少(約100–1000個(gè))。
在IL-12信號(hào)傳導(dǎo)中,IL-12Rβ1和IL-12Rβ2的胞內(nèi)區(qū)分別結(jié)合不同的Janus激酶:IL-12Rβ1主要結(jié)合Tyk2,而IL-12Rβ2結(jié)合JAK2。IL-12與受體結(jié)合后,受體相關(guān)的JAK2和TYK2被活化并發(fā)生自磷酸化,進(jìn)而磷酸化受體胞內(nèi)區(qū)上的酪氨酸。IL-12Rβ2上關(guān)鍵的磷酸化位點(diǎn)(如Y800)為STAT4提供結(jié)合位點(diǎn),形成信號(hào)平臺(tái)。此外,STAT4可被激酶家族中的p38 MAPK磷酸化(絲氨酸位點(diǎn)),這一修飾對(duì)STAT4的轉(zhuǎn)錄活性和IFN-γ產(chǎn)生至關(guān)重要。此外,IL-12還可激活PI3K/Akt通路,促進(jìn)T細(xì)胞增殖。
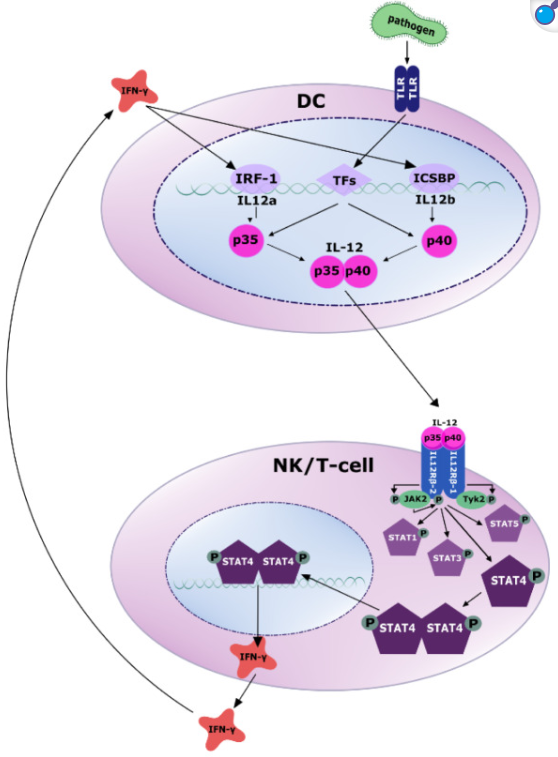
抗原呈遞細(xì)胞 (APC),例如樹突狀細(xì)胞,通過 Toll 樣受體(TLR) 感知 PAMP(病原體相關(guān)分子模式)。隨后,多種轉(zhuǎn)錄因子被激活,誘導(dǎo) IL-12p35 和 IL-12p40 的轉(zhuǎn)錄(更多詳情請(qǐng)參閱原文)。分泌的 IL-12 異二聚體與 NK 細(xì)胞和 T 細(xì)胞上的受體結(jié)合,募集酪氨酸激酶 JAK2 和 TYK2,并通過酪氨酸磷酸化激活 JAK2。活化的 JAK2 磷酸化 IL12Rβ2 亞基,進(jìn)而通過磷酸化激活 STAT4。隨后,磷酸化的 STAT4 發(fā)生同二聚化或異二聚化,轉(zhuǎn)位至細(xì)胞核,并通過結(jié)合靶 DNA 調(diào)控基因轉(zhuǎn)錄。主要靶基因是 IFN-γ,其反過來通過 IRF-1 和 ICSBP 誘導(dǎo) IL-12 產(chǎn)生的轉(zhuǎn)錄激活。
IL-12信號(hào)的負(fù)反饋調(diào)控
為防止過度的炎癥反應(yīng),IL-12信號(hào)通路受到多種負(fù)反饋機(jī)制的制約。抑制性細(xì)胞因子信號(hào)分子SOCS-3是IL-12負(fù)調(diào)節(jié)的關(guān)鍵分子之一。SOCS-3的SH2結(jié)構(gòu)域能夠識(shí)別并結(jié)合磷酸化的IL-12Rβ2上的Y800位點(diǎn),從而競爭性阻斷STAT4與受體的結(jié)合。研究顯示,在高表達(dá)SOCS-3的Th2細(xì)胞中,IL-12介導(dǎo)的STAT4活化被強(qiáng)烈抑制,表明SOCS-3在Th2細(xì)胞中防止IL-12信號(hào)介導(dǎo)的Th1極化。除SOCS-3外,其他SOCS蛋白或蛋白酪氨酸磷酸酶也可能參與IL-12信號(hào)的調(diào)控,但SOCS-3對(duì)IL-12Rβ2的抑制作用是已知的經(jīng)典機(jī)制。此外,IL-12能誘導(dǎo)的IFN-γ和其它下游效應(yīng)也可間接反饋調(diào)節(jié)IL-12的生成,但主要的細(xì)胞內(nèi)負(fù)反饋仍歸功于SOCS-3等分子的作用。
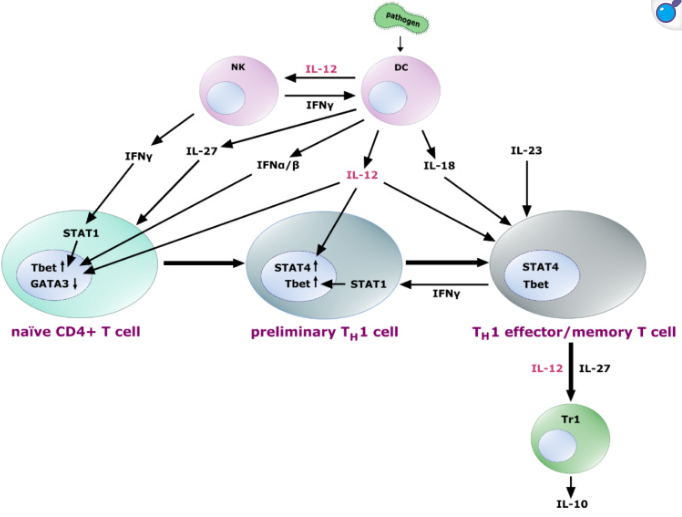
暴露于 IL-27 的幼稚 T 細(xì)胞表達(dá) IL-12 受體異二聚體,使細(xì)胞對(duì) IL-12 的影響敏感。IL-12 與來自 NK 細(xì)胞和反饋回路的 IFN-γ(IFN-α和 IFN-β)共同誘導(dǎo)轉(zhuǎn)錄因子 Tbet的上調(diào)和 GATA3的下調(diào),從而初步實(shí)現(xiàn) TH1 分化。進(jìn)一步暴露于 IL-12 會(huì)導(dǎo)致這些早期 TH1 細(xì)胞中 STAT4 的上調(diào),隨后它們分化為 TH1 效應(yīng) T 細(xì)胞和記憶 T 細(xì)胞。IL-18和 IL-23 有助于 TH1 細(xì)胞效應(yīng)功能的固定、擴(kuò)增和維持。分化的 TH1 細(xì)胞產(chǎn)生 IFN-γ,通過 STAT1 增強(qiáng) Tbet 的表達(dá),從而形成正反饋回路。此外,它們能夠促進(jìn) IL-10 分泌 Tr1 細(xì)胞,這一過程可能由 IL-12 和 IL-27 信號(hào)介導(dǎo)。
IL-12的上游誘導(dǎo)因素
IL-12的產(chǎn)生主要由樹突狀細(xì)胞和巨噬細(xì)胞介導(dǎo),這些抗原呈遞細(xì)胞在受到病原體相關(guān)分子模式(PAMPs)刺激后通過TLR通路激活相關(guān)轉(zhuǎn)錄因子來合成IL-12。經(jīng)典的例子包括細(xì)胞毒性鏈霉菌毒素(CpG)激活TLR9、脂多糖(LPS)激活TLR4或其他TLR激活均能誘導(dǎo)IL-12的表達(dá)。分子機(jī)制上,TLR3/4活化時(shí)細(xì)胞內(nèi)IRF-3可結(jié)合IL-12p35基因啟動(dòng)子中的ISRE元件,促進(jìn)p35轉(zhuǎn)錄。同時(shí),NF-κB和AP-1等轉(zhuǎn)錄因子也參與IL-12p40亞基的啟動(dòng)子激活(相關(guān)文獻(xiàn)顯示IRF-5等因子可誘導(dǎo)p40的表達(dá),未于此重點(diǎn)討論)。在炎癥環(huán)境中,IFN-γ是IL-12產(chǎn)生的強(qiáng)烈增強(qiáng)因子:IFN-γ能誘導(dǎo)轉(zhuǎn)錄因子IRF-1和ICSBP(IRF-8),分別作用于IL-12p35和p40基因,形成正反饋環(huán)路。結(jié)果是IL-12激發(fā)的初始IFN-γ分泌又進(jìn)一步提高后續(xù)IL-12的生成。此外,炎性細(xì)胞因子IL-18雖然自身對(duì)IFN-γ誘導(dǎo)作用有限,但與IL-12協(xié)同時(shí)可顯著放大IFN-γ的產(chǎn)生:IL-18通過STAT4和AP-1增強(qiáng)IFN-γ基因轉(zhuǎn)錄,特別在巨噬細(xì)胞或B細(xì)胞等非經(jīng)典IFN-γ來源細(xì)胞中尤為重要。總之,IL-12的上游誘導(dǎo)涉及TLR-介導(dǎo)的NF-κB/IRF信號(hào)通路,以及IFN-γ/IL-18等炎癥因子的正反饋放大效應(yīng),確保IL-12在免疫應(yīng)答中的及時(shí)釋放。
IL-12的下游生物學(xué)效應(yīng)
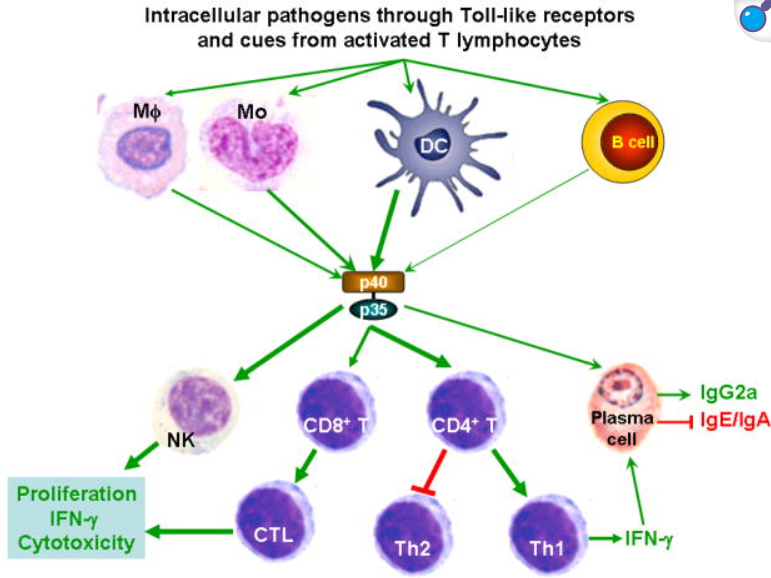
IL-12的主要生物學(xué)作用是激活先天和適應(yīng)性免疫效應(yīng)細(xì)胞,從而引導(dǎo)免疫應(yīng)答向Th1型極化。IL-12可直接刺激自然殺傷(NK)細(xì)胞和T淋巴細(xì)胞,使其大量分泌IFN-γ并增強(qiáng)細(xì)胞毒性。在CD4+ T細(xì)胞中,IL-12通過STAT4信號(hào)促進(jìn)幼稚T細(xì)胞分化為Th1細(xì)胞,使Th1分泌表型(如高水平IFN-γ、T-bet表達(dá))得到建立。IFN-γ反過來上調(diào)MHC分子、促進(jìn)巨噬細(xì)胞殺菌效能,并促進(jìn)IL-12Rβ2的表達(dá),形成正反饋,進(jìn)一步鞏固Th1極化。IL-12還能抑制Th2細(xì)胞相關(guān)因子的表達(dá),使免疫應(yīng)答更加偏向細(xì)胞介導(dǎo)的抗原特異性免疫。在CD8+ T細(xì)胞中,IL-12作為“信號(hào)3”參與初始激活,可促進(jìn)效應(yīng)CD8+ T細(xì)胞的增殖和細(xì)胞毒作用,并對(duì)其向長期記憶細(xì)胞轉(zhuǎn)化具有關(guān)鍵作用。研究表明,在抗原初次遇到早期,如果CD8+ T細(xì)胞獲得IL-12或Ⅰ型干擾素信號(hào),其后可形成具有保護(hù)性效應(yīng)的記憶T細(xì)胞群體。此外,IL-12也能間接促進(jìn)B細(xì)胞的輔助活性,如通過誘導(dǎo)Th1細(xì)胞表位幫助B細(xì)胞產(chǎn)生IgG2a(未于此詳細(xì)展開)。總體而言,IL-12通過增強(qiáng)NK細(xì)胞和CTL功能、驅(qū)動(dòng)Th1細(xì)胞分化并促進(jìn)記憶T細(xì)胞生成,實(shí)現(xiàn)先天免疫與適應(yīng)性免疫的橋接。
不同微環(huán)境中的IL-12調(diào)控與細(xì)胞選擇性效應(yīng)
IL-12信號(hào)的效果高度依賴于組織和炎癥微環(huán)境的特點(diǎn)。在感染性炎癥微環(huán)境中(如細(xì)菌、寄生蟲感染),IL-12產(chǎn)生通常被顯著誘導(dǎo):巨噬細(xì)胞或樹突狀細(xì)胞通過TLR識(shí)別病原時(shí)大量分泌IL-12,以促進(jìn)強(qiáng)烈的Th1反應(yīng)和IFN-γ釋放。臨床上已知IL-12Rβ1缺陷會(huì)嚴(yán)重?fù)p害機(jī)體對(duì)結(jié)核分枝桿菌和沙門氏菌等胞內(nèi)病原的清除能力,突顯IL-12在抗感染中的關(guān)鍵作用。相反,在慢性炎癥或腫瘤微環(huán)境中,IL-12信號(hào)經(jīng)常受到抑制。許多腫瘤細(xì)胞通過激活STAT3信號(hào)通路和分泌IL-10、TGF-β等抑制性因子來抑制IL-12的生成,同時(shí)增強(qiáng)IL-23的產(chǎn)生,使免疫偏向促炎的Th17/IL-17路徑。這種IL-12/IL-23平衡的轉(zhuǎn)變利于腫瘤或慢性炎癥的持續(xù)發(fā)展。針對(duì)腫瘤免疫治療研究發(fā)現(xiàn),高劑量IL-12治療往往伴隨機(jī)體產(chǎn)生大量IL-10反調(diào)節(jié),但I(xiàn)L-12仍能極大增強(qiáng)腫瘤特異性CTL應(yīng)答。在小鼠腫瘤模型中,IL-12給藥可顯著延緩腫瘤生長,并誘導(dǎo)腫瘤內(nèi)部產(chǎn)生抑制血管生成的趨化因子(如IP-10、MIG)。臨床試驗(yàn)也觀察到IL-12治療后腫瘤患者外周血和轉(zhuǎn)移灶中腫瘤特異性CD8+ CTL及記憶T細(xì)胞顯著增多。此外,IL-12的細(xì)胞選擇性效應(yīng)也十分明確:例如Th2細(xì)胞高水平表達(dá)SOCS-3,可阻斷IL-12介導(dǎo)的STAT4信號(hào),導(dǎo)致Th2對(duì)IL-12響應(yīng)性很低。相反,Th1細(xì)胞則能有效響應(yīng)IL-12刺激。綜上所述,IL-12信號(hào)在感染環(huán)境中被增強(qiáng)以促進(jìn)免疫防御,而在腫瘤或慢性炎癥中常被負(fù)反饋抑制;不同免疫細(xì)胞對(duì)IL-12反應(yīng)的差異則決定了其細(xì)胞選擇性效應(yīng)。
IL-12在免疫治療中的應(yīng)用潛力
鑒于IL-12在連接先天與適應(yīng)性免疫中的中心作用,它成為免疫治療的重要靶點(diǎn)之一。在抗腫瘤免疫方面,IL-12能通過增強(qiáng)CTL和NK細(xì)胞介導(dǎo)的殺傷以及抑制腫瘤血管生成來發(fā)揮作用。研究發(fā)現(xiàn)IL-12刺激的IFN-γ可上調(diào)腫瘤細(xì)胞表面MHC和ICAM-1分子,并誘導(dǎo)內(nèi)皮細(xì)胞產(chǎn)生IP-10/MIG等抗血管生成因子,從而抑制腫瘤生長。小鼠實(shí)驗(yàn)顯示,IL-12單獨(dú)或作為疫苗佐劑可顯著延長腫瘤模型動(dòng)物生存期并提高腫瘤特異性免疫應(yīng)答。例如,將IL-12基因?qū)肽[瘤疫苗中,與常規(guī)疫苗聯(lián)合使用時(shí)比單獨(dú)使用任何一種效果更佳。然而,系統(tǒng)給藥IL-12常導(dǎo)致顯著炎癥毒性,現(xiàn)代策略正探索局部釋放(如腫瘤內(nèi)注射)、基因治療或與其它檢查點(diǎn)抑制劑聯(lián)合的方案,以優(yōu)化療效并減少副作用。此外,IL-12通路的調(diào)控也為治療自身免疫疾病提供了思路,針對(duì)IL-12/IL-23p40亞基的抗體(如烏司奴單抗)已用于銀屑病和克羅恩病等炎性疾病,說明IL-12信號(hào)作為調(diào)節(jié)節(jié)點(diǎn)在免疫治療中具有雙重意義(既可增強(qiáng)抗原反應(yīng)亦可通過阻斷減輕自身炎癥)。總體來看,最新研究繼續(xù)揭示IL-12信號(hào)在不同病理狀態(tài)下的動(dòng)態(tài)作用機(jī)制和調(diào)控手段,使其在疫苗設(shè)計(jì)、腫瘤免疫和自身免疫治療等領(lǐng)域擁有重要的應(yīng)用前景。
參考文獻(xiàn):
Ullrich, K. A., Schulze, L. L., Paap, E. M., Müller, T. M., Neurath, M. F., & Zundler, S. (2020). Immunology of IL-12: An update on functional activities and implications for disease.EXCLI journal,19, 1563–1589. https://doi.org/10.17179/excli2020-3104
Gerber, A. N., Abdi, K., & Singh, N. J. (2021). The subunits of IL-12, originating from two distinct cells, can functionally synergize to protect against pathogen dissemination in vivo.Cell reports,37(2), 109816. https://doi.org/10.1016/j.celrep.2021.109816
Liu, J., Cao, S., Kim, S., Chung, E. Y., Homma, Y., Guan, X., Jimenez, V., & Ma, X. (2005). Interleukin-12: an update on its immunological activities, signaling and regulation of gene expression.Current immunology reviews,1(2), 119–137. https://doi.org/10.2174/1573395054065115
Watford WT, Hissong BD, Bream JH, Kanno Y, Muul L, O'Shea JJ. Signaling by IL-12 and IL-23 and the immunoregulatory roles of STAT4.Immunol Rev. 2004;202:139-156. doi:10.1111/j.0105-2896.2004.00211.x
Xiao Z, Casey KA, Jameson SC, Curtsinger JM, Mescher MF. Programming for CD8 T cell memory development requires IL-12 or type I IFN.J Immunol. 2009;182(5):2786-2794. doi:10.4049/jimmunol.0803484
Goriely S, Molle C, Nguyen M, et al. Interferon regulatory factor 3 is involved in Toll-like receptor 4 (TLR4)- and TLR3-induced IL-12p35 gene activation.Blood. 2006;107(3):1078-1084. doi:10.1182/blood-2005-06-2416
Xu, M., Mizoguchi, I., Morishima, N., Chiba, Y., Mizuguchi, J., & Yoshimoto, T. (2010). Regulation of antitumor immune responses by the IL-12 family cytokines, IL-12, IL-23, and IL-27.Clinical & developmental immunology,2010, 832454. https://doi.org/10.1155/2010/832454
Floss, D. M., Kl?cker, T., Schr?der, J., Lamertz, L., Mrotzek, S., Strobl, B., Hermanns, H., & Scheller, J. (2016). Defining the functional binding sites of interleukin 12 receptor β1 and interleukin 23 receptor to Janus kinases.Molecular biology of the cell,27(14), 2301–2316. https://doi.org/10.1091/mbc.E14














